
엘리언과 히칭스
1930년대 말부터 제약회사 버크스웰컴(Burroughs Wellcome) 연구소에서 함께 일한 거트루드 엘리언(왼쪽)과 조지 히칭스(오른쪽)의 모습입니다. 연구실에서 핵산 대사를 연구하며 새로운 항암제를 고안한 이 둘은 혁신적인 신약 개발 방법을 개척했습니다.
1944년, 조지 히칭스 박사는 뉴욕 북부 Tuckahoe에 있는 버크스웰컴 연구소의 작은 생화학부에 몸담고 있었습니다. 당시 히칭스는 연구 보조원을 한 명 두고 있었는데, 추가로 한 명을 뽑으라는 통보를 받았습니다. 그 무렵 뉴욕 브롱크스에 살던 거트루드 엘리언은 박사과정 진학을 준비하며 연구 보조원직을 찾고 있었습니다. 우연히 엘리언의 아버지가 구입한 약의 관련 샘플로 인해, 엘리언은 버크스웰컴에 취직 문의를 하게 되었습니다. 1944년 어느 토요일 아침, 엘리언은 히칭스 박사를 만나 면접을 보았고, 일주일 만에 채용 제의를 받았습니다. 히칭스는 여성이라는 이유로 채용을 미루지 않는 드문 사람이었고, 엘리언에게도 능력에 걸맞은 기회를 주었습니다. 이후 히칭스는 엘리언에게 점차 큰 연구 과제를 맡기며 여성 과학자로서의 자질을 신뢰했습니다.
엘리언은 어려서 위암으로 할아버지를 잃은 경험을 계기로 암 치료제 개발을 결심했습니다. 고등학교와 대학에서 화학을 전공한 후, 그녀는 수많은 박사과정 지원에서 탈락하고, 연구직조차 구하기 어려운 성차별의 벽에 부딪혔지만 포기하지 않았습니다. 제2차 세계대전 중에는 여성의 과학 분야 진출 기회가 늘었고, 엘리언도 식품 회사와 제약 회사 등의 임시직을 거쳐 마침내 1944년 히칭스의 연구소에 합류했습니다. 히칭스는 그녀가 박사 학위 없이도 훌륭한 연구를 할 수 있음을 믿었고, 엘리언은 1940년대 말부터 히칭스와 함께 버크스웰컴에 평생 몸담으며 연구에 몰두했습니다.
합리적 설계에 기반한 연구 방법론
히칭스 박사는 당시 통용되던 우연 발견에 의존한 신약 개발을 벗어나, 생체 대사를 기반으로 약물을 설계하는 혁신적인 방법을 고민했습니다. 그는 이미 경험적으로 성공을 거둔 설파약 연구를 보며, 세균의 대사경로를 차단하는 방식이 항암제 개발에도 적용될 수 있다고 판단했습니다. 히칭스는 정상세포와 암세포 간, 또는 세균·원충·바이러스 등 유해 미생물과 인간세포 간에 핵산(DNA·RNA) 대사의 차이가 존재할 것이라 가정했습니다. 즉, 이러한 차이를 이용해 암세포의 핵산 합성을 선택적으로 억제할 수 있는 화합물을 만드는 것이 목표였습니다.
이를 위해 히칭스는 엘리언에게 DNA를 이루는 기본구조인 퓨린 분자(아데닌, 구아닌 등)를 집중적으로 연구하게 했습니다. 두 사람은 실험을 통해 세균 세포가 DNA 합성을 위해 특정 퓨린 성분을 필요로 한다는 사실을 발견했습니다. 이를 바탕으로 “퓨린 성분이 DNA 합성 경로에 들어가지 못하도록 막으면 DNA 생산을 중단시켜 세포 성장을 멈출 수 있을 것”이라는 가설을 세우고, 핵산 합성에 필수적인 효소에 결합함으로써 이 과정을 차단하는 물질들을 합성하기 시작했습니다. 이처럼 히칭스와 엘리언은 이론적 배경과 분자 수준의 생화학적 원리에 기반해 약물을 설계하는 합리적 신약개발(rational drug design) 방식을 도입했습니다.
초기 항대사제 개발과 임상시험
이러한 연구를 통해 1950년경까지 히칭스·엘리언 팀은 암세포의 성장 억제에 효과적인 첫 항대사제를 개발합니다. 아데닌 유사체인 디아미노퓨린과 구아닌 유사체인 티오구아닌(thioguanine)이 그 결과물입니다. 이들 화합물은 정상 퓨린 대신 암세포의 대사효소에 결합하여 DNA 합성을 차단함으로써, 급성 백혈병 세포의 분열과 증식을 억제했습니다. 실제로 동물실험과 임상시험에서 백혈병 세포 수가 감소하고 일시적 관해(remission)가 관찰되어, 의학계는 이들 약물을 백혈병 치료의 첫 혁신적 항암제로 환영했습니다.
다만 합성된 디아미노퓨린과 티오구아닌은 효과는 있었지만 독성이 강했습니다. 환자에게 심한 구토를 유발하는 등 부작용이 컸습니다. 엘리언은 부작용이 덜한 물질을 찾기 위해 퓨린 구조를 다양한 방식으로 변형하기 시작했고, 100여 종의 퓨린 유도체를 시험한 끝에 드디어 6-머캅토퓨린(6-mercaptopurine, 상표명 Purinethol)을 합성해냈습니다. 6-머캅토퓨린은 퓨린 분자의 6번 위치에 있는 산소 원자를 황으로 치환한 구조로, 티오구아닌과 매우 유사한 화합물입니다. 이 물질은 앞서 개발된 항대사제보다 독성이 비교적 낮으면서도 유사한 항암 효과를 보여주었습니다.
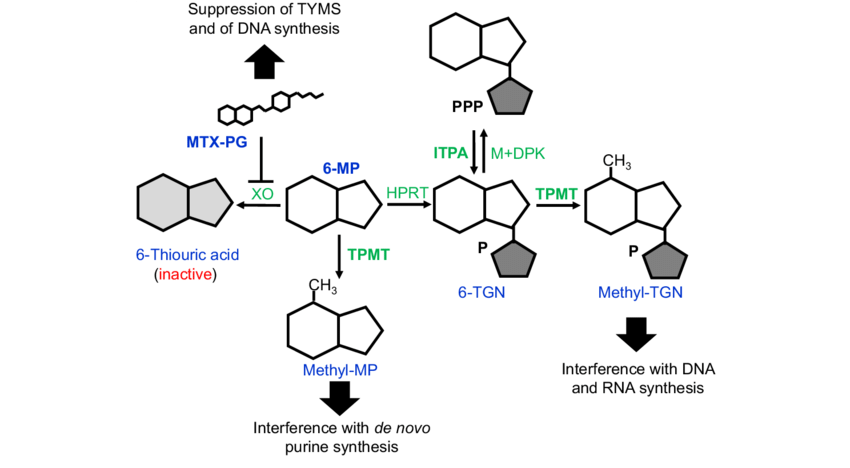
6-머캅토퓨린의 생화학적 작용기전
6-머캅토퓨린은 퓨린 유사체로 작용하여 핵산 합성을 방해하는 약물입니다. 체내에서는 히포잔틴-구아닌 인산포스포리보실전달효소(HGPRT)의 작용을 받아 먼저 티오이노신 일인산(TIMP)으로 전환됩니다. TIMP는 퓨린의 de novo 합성 경로에서 중요한 중간단계 효소들을 억제합니다. 예를 들어, IMP(이노신일인산)에서 XMP로, 또는 AMP(아데닐산)로 가는 일련의 반응들이 TIMP에 의해 차단됩니다. 더 나아가 TIMP의 메틸화 산물인 6-메틸티오이노시네이트(MTIMP)도 퓨린 합성 초기 단계의 효소(글루타민-5-포스포리보실프롤기르탄분해효소)를 억제합니다. 이로 인해 퓨린 뉴클레오티드의 생산이 크게 감소하고, 결국 DNA와 RNA 합성이 지연되어 S기 세포 분열이 중단됩니다. 6-머캅토퓨린은 하이포잔틴과 구아닌과 경쟁하여 효소에 결합하므로, 일종의 구조적 ‘말단기’처럼 작용하여 암세포의 증식을 효과적으로 억제합니다.
임상 적용과 의학계의 반응
개발된 6-머캅토퓨린은 즉시 실험과 임상시험에 투입되었습니다. 1953년 8월에는 클라크(Donald Clarke) 박사 등이 쥐의 종양모델에서 6-머캅토퓨린을 투여한 결과 종양이 현저히 축소되고 심지어 일부 종양이 완전히 퇴축함이 보고되었습니다. 같은 해 11월에는 비숍(Burchenal) 박사가 소아 급성백혈병 환자 임상시험 결과를 발표했는데, 6-머캅토퓨린 단독으로 수개월에서 수년 간 장기간 관해(remission)를 유도한 사례들이 보고되었습니다. 그해 말 미국 FDA는 6-머캅토퓨린을 어린이 백혈병 치료제로 공식 승인했습니다.
초기 연구결과는 암 치료의 새 시대를 알리는 것이었지만, 곧 한계도 드러났습니다. 6-머캅토퓨린 단독으로 투여할 경우 많은 환자가 일시 관해를 경험했으나 재발이 잦았습니다. 엘리언은 이 약물의 체내 대사를 면밀히 조사했고, 그 결과 메토트렉세이트(methotrexate)와 같은 다른 항암제와 함께 병용요법을 사용할 때 치료효과가 획기적으로 향상됨을 알게 되었습니다. 이후 다수의 소아백혈병 전문의들은 6-머캅토퓨린과 티오구아닌에 메토트렉세이트, 백혈병 치료제 등 여러 약물을 일정 기간 병용하는 치료 프로토콜을 확립했습니다. 이른바 전신화학요법(combination therapy)의 도입으로 소아 급성 림프구성 백혈병의 약 80% 이상가 완치에 가까운 결과를 얻을 수 있게 되었습니다. 이러한 성과는 히칭스·엘리언의 항대사제 연구가 백혈병 치료 패러다임을 완전히 바꾸어 놓았음을 입증했습니다. 의학계는 그동안 거의 치료가 불가능하다고 여겨졌던 백혈병에 관해와 치유라는 개념을 본격적으로 다루기 시작했고, 전 세계 암연구자들은 이들의 발견을 토대로 신약 개발에 박차를 가했습니다.
성과와 노벨상 수상
히칭스와 엘리언의 연구협력은 이후에도 계속되었고, 그 성과는 백혈병 외에도 이식거부반응 억제제(아자치오프린), 통풍치료제(알로퓨리놀) 등으로 이어졌습니다. 이들의 연구 방법론은 산업계에 새로운 패러다임을 제시했고, 실제로 아자치오프린(1957년)과 알로퓨리놀(1963년) 같은 의약품이 이들 실험실에서 개발되었습니다. 특히 엘리언과 히칭스는 1950년대에 티오구아닌과 6-머캅토퓨린을 개발한 공로로 학계의 찬사를 받았고, 1988년에는 노벨 생리의학상을 공동 수상했습니다. 노벨위원회는 이들이 “정상 세포와 암세포 간의 핵산 대사 차이를 밝히고 이를 토대로 수많은 신약을 개발했다”는 점을 높이 평가했습니다. 엘리언은 이 수상을 통해 여성 과학자와 박사학위 미소지자로서는 이례적으로 권위 있는 성취를 이루었으며, 히칭스와 함께 제약회사 연구자로서도 극히 드물게 노벨상을 받은 사례가 되었습니다. 이들의 협력은 과학계에 합리적 신약 설계(rational drug design)의 가치를 각인시켰고, 이후 항바이러스제 아시클로버(Acyclovir) 같은 신약 개발에까지 영향을 미쳤습니다. 노벨위원회도 “과거에는 자연물 기반으로 이뤄지던 신약 개발이었지만, 이들은 기초 생체·생리학적 원리를 기반으로 약물을 설계하는 새로운 방식을 도입했다”고 평가했습니다.
엘리언과 히칭스의 40여 년간 협력 연구는 많은 의료인의 목숨을 구했을 뿐 아니라, 현대 약학 연구에 지울 수 없는 족적을 남겼습니다. 특히 6-머캅토퓨린의 개발은 “백혈병 치료가 불가능하다”는 고정관념에 도전한 역사적 계기가 되었고, 지금도 소아 백혈병 유지요법의 중요한 구성요소로 사용되고 있습니다. 이처럼 히칭스와 엘리언이 개척한 합리적 신약 설계 방식은 그 이후 제약 개발 전반에 큰 영향을 주며, 현재까지도 항암제·항바이러스제·면역억제제 등 다양한 분야에서 새 약물을 설계하는 밑거름이 되고 있습니다.
TMI
리투아니아 이민자의딸인 거트루드 엘리언은 일찍부터 과학에 재능을보였고 화학지식에 목말라 했다. 그녀는 낮에는고등학교에서 과학을 가르치고, 밤이나주말에는 연구를하면서 1941년뉴욕대학교에서 화학석사학위를마쳤다. 비록 자질과 재능이 뛰어나고 의지도강했지만, 그녀는화학 연구실에 일자리를구할수 없었다. 계속되는 거절에 자포자기한 나머지 그녀는슈퍼마켓 상품관리자로 취직했다. 히칭스가발견했을당시에 트루디 엘리언(그녀의 애칭)은뉴욕의한식품 연구실에서 피클의산성도와마요네즈에 들어갈 달걀 노른자의 색깔을 검사하는 일을 하고 있었다.그녀는 곧 당대의 가장 혁신적인 합성화학자의 반열에 오르게 된다(그리고미래의 노벨상 수상자가 된다.)- 암, 만병의 황제의 역사
그녀는 뉴욕시 소재 여자대학교인 헌터 대학교를 다녔으며, 이 학교는 성적이 우수한 젊은 여성들의 입학을 허가했습니다. 그가 수석으로 최고 영예로 졸업했지만, 15개의 대학원에 지원했지만, 모두 받아들여지지 않았습니다.
그녀에 대한 이야기는 "내가 만난 여성 과학자들"에 자세히 언급되어 있습니다.

참고로 그들이 근무한 회사는 후에 글락소에 합병되어 글락소 웰컴이 되었고 현재는 GSK 가 되었습니다.
'생활면역' 카테고리의 다른 글
| 유전자 속 악마와 천사: src와 ras 온코진의 발견과 암 연구의 혁명 (17) | 2025.08.11 |
|---|---|
| 비타민 B3의 항암효과 확실한 것일까? (8) | 2025.08.08 |
| 담배와 폐암의 연관성 발견: 돌과 힐의 여정 (21) | 2025.08.07 |
| 디에틸스틸베스트롤(DES): 희망의 약에서 비극의 발암물질로 밝혀지기까지의 기록 (18) | 2025.08.06 |
| B형 간염 바이러스 발견과 블룸버그 박사의 연구 여정 (15) | 2025.08.05 |



